原因不明な繰り返す腹痛に潜在する希少疾患
治療可能となった急性肝性ポルフィリン症を「見つかる」から「見つける」へ
-
座長
-
田妻 進
先生
JA尾道総合病院 病院長
救急外来を受診する患者の5~10%が腹痛を訴え、急性腹症のうち約33%は診断のつかない「非特異的腹痛(NSAP∗1)」とされている。
稀な疾患である急性肝性ポルフィリン症(AHP)はNSAPとして扱われることもあり、診断までに長期間を要するなど早期診断が難しい疾患とされてきた。
しかしながらAHPの治療薬としてsiRNA∗2製剤が開発され、また、令和4年度診療報酬改定では急性間欠性ポルフィリン症(AIP)、遺伝性コプロポルフィリン症(HCP)、異型ポルフィリン症(VP)が遺伝学的検査の対象疾患に追加されるなど、AHPの診断・治療は近年大きな進歩を遂げた。
そこで本シンポジウムは、「治療可能となった急性肝性ポルフィリン症を『見つかる』から『見つける』へ」と題し、AHPの早期診断・治療についてディスカッションする場とした。
- ∗1
- Non-Specific Abdominal Pain
- ∗2
- 低分子干渉RNA(small interfering RNA)
腹痛に潜む希少疾患
急性肝性ポルフィリン症(AHP)の病態について
-
多胡 雅毅
先生
佐賀大学医学部附属病院 総合診療部 准教授
救急外来受診者の5~10%が腹痛を主訴に受診するとされており1)、当院の調査でも総合診療部外来を訪れる新患の約15%が腹痛を訴えることが明らかになっている。原因臓器が多岐にわたること、見逃すと致命的となる急性腹症が含まれることなどから腹痛の診断は難しく、また慎重さも求められる。
AHPは、肝臓におけるヘム生合成経路に関わる特定の酵素の異常により発症する遺伝性の代謝性疾患である。ヘム生合成経路における律速酵素である5'-アミノレブリン酸合成酵素1(ALAS1)の発現亢進により、神経毒性を有すると考えられているヘム前駆体であるアミノレブリン酸(ALA)やポルフォビリノーゲン(PBG)が体内で過剰に産生されることで、激しい腹痛などを引き起こす。末梢神経系、中枢神経系、自律神経系などに症状がみられることもある。年齢ごとに発症頻度が異なり、AIP、HCPは20代での発症が多い。女性の発症が多く、その理由としてALAS1発現亢進の誘発因子である「女性ホルモン」との関連が示唆されている。ALAS1は一部の薬剤や性ホルモン、ダイエット、アルコール、喫煙などが誘発因子となり、発現が亢進する。
AHPの病型のうち最も頻度の高いAIPでは、PBG脱アミノ酵素(PBGD)/ヒドロキシメチルビラン合成酵素(HMBS)の活性低下により、ALA及びPBGが過剰に産生され、症状が発現する。
AIP患者に生じるALA及びPBGの過剰産生メカニズムについて、「思春期前」と「思春期以降」でみると、「思春期前」はALAやPBGが産生されるものの、性ホルモンなどのALAS1誘発因子の曝露が少なく、症状が発現することは少ない。一方、「思春期以降」では、誘発因子によりALAS1の発現が亢進し、ALAやPBGが過剰に産生される。また、チトクロームP450(CYP)の合成などでヘムの消費が増加すると、ALAS1に対する強いポジティブフィードバックが生じ、さらにALAS1の発現が亢進することで、ALAやPBGの過剰産生が顕著になる。このようなメカニズムで症状発症時のAIP患者では、激しい腹痛などが発現する(図❶)。
図❶AIP患者に生じるALAとPBGの複合的な過剰産生メカニズム
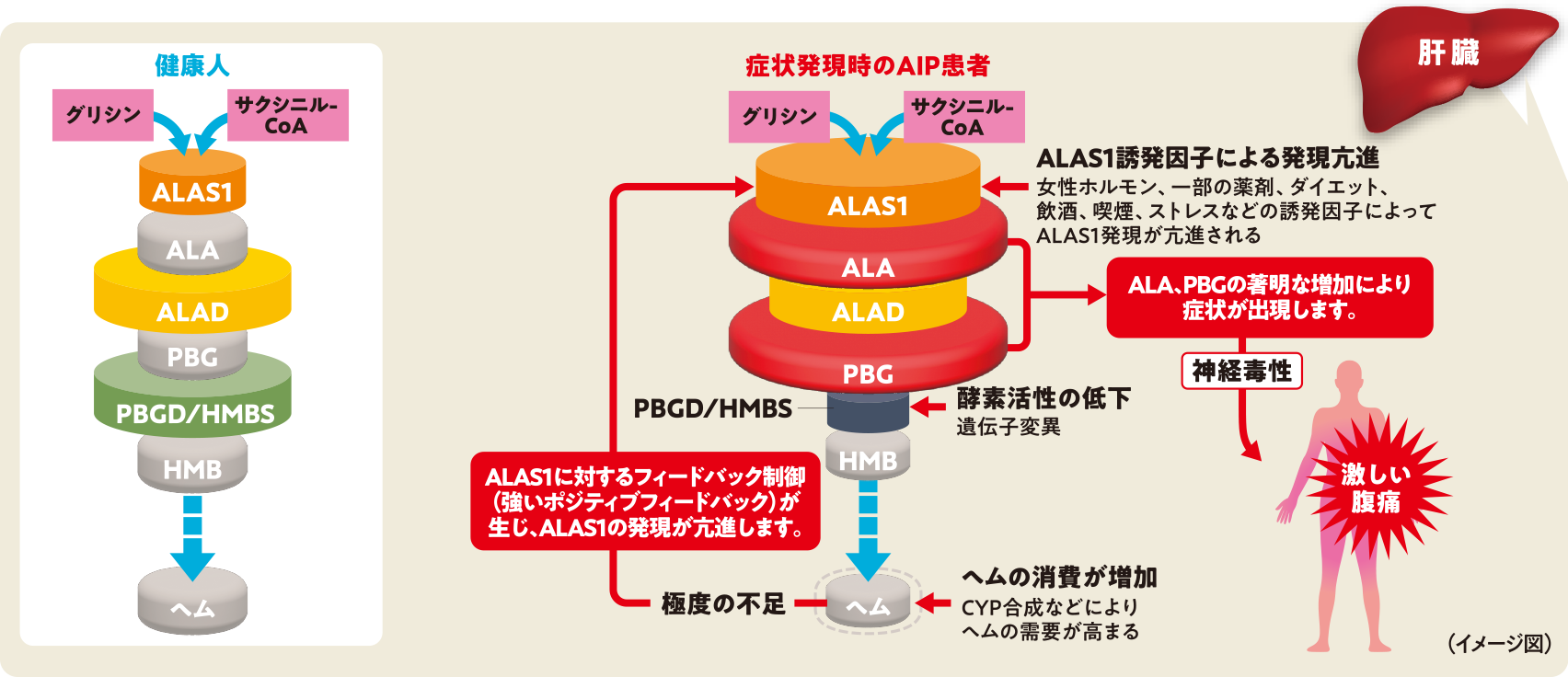
- AIP
- 急性間欠性ポルフィリン症
- ALAS1
- 5’-アミノレブリン酸合成酵素1
- ALA
- アミノレブリン酸
- PBG
- ポルフォビリノーゲン
- ALAD
- ALA脱水酵素
- PBGD
- PBG脱アミノ酵素
- HMBS
- ヒドロキシメチルビラン合成酵素
- HMB
- ヒドロキシメチルビラン
- CYP
- チトクロームP450
- 監修
- 古山和道先生(岩手医科大学 生化学講座 分子医化学分野 教授)
(多胡雅毅 先生 ご提供)
また、ALA及びPBGの過剰産生による長期的な合併症(高血圧、慢性腎臓病、肝細胞癌など)への影響も知られている2-4)。診断までの期間が長く精神症状を含む激しい症状がみられることのあるAHPは社会生活が制限される疾患であり、そのため早期診断が課題となっている。
薬物治療については、従来はヘミン製剤が使用されてきたが、現在はsiRNA製剤も使用可能となった。siRNA製剤は、ALAS1 mRNAを特異的に分解することでALAS1の発現を抑制する新たな作用機序を有するもので、期待も高い。
急性腹症の鑑別診断とAHP
-
佐々木 陽典
先生
東邦大学医療センター大森病院 総合診療・急病センター(内科) 講師
腹痛は日常診療において最もありふれた愁訴の1つである。しかし腹痛は、腹腔内の臓器がオーバーラップしていること、個人差が大きいこと、また、腹部以外の疾患が原因になることもあり、その診断は極めて困難である。
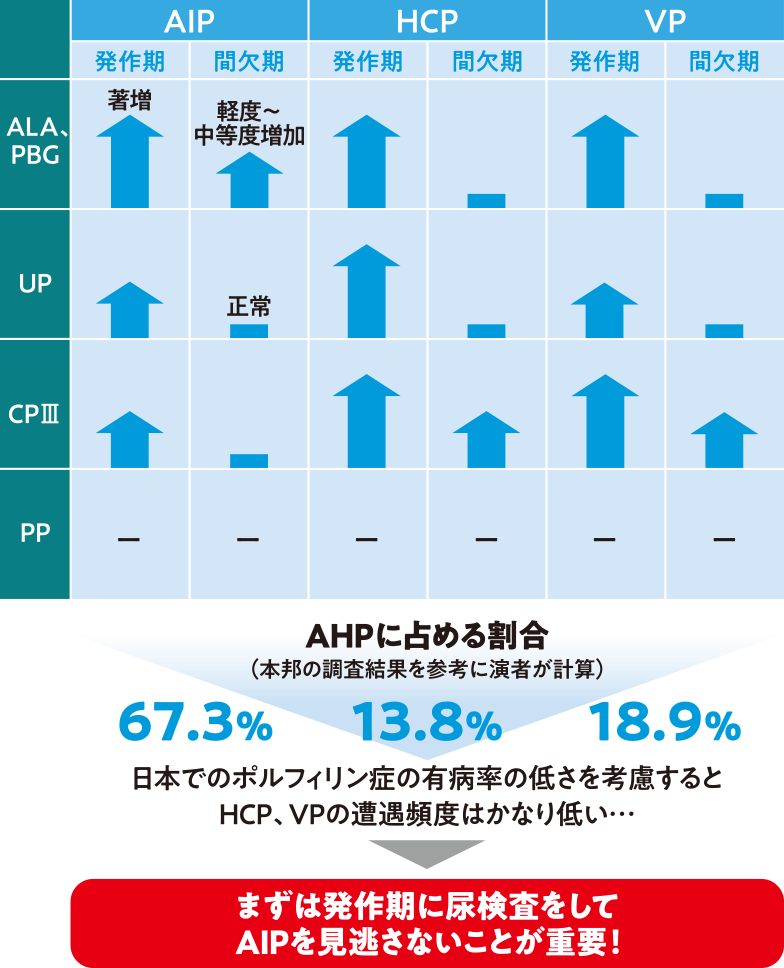
図❷AHPの発作時・間欠期の尿検査所見
- AHP
- 急性肝性ポルフィリン症
- AIP
- 急性間欠性ポルフィリン症
- HCP
- 遺伝性コプロポルフィリン症
- VP
- 異型ポルフィリン症
- ALA
- アミノレブリン酸
- PBG
- ポルフォビリノーゲン
- UP
- ウロポルフィリン
- CPⅢ
- コプロポルフィリンⅢ
- PP
- プロトポルフィリン
(佐々木陽典 先生 ご提供)
救急外来を受診する患者が訴える症状のうち5%以上が腹痛とされ、その原因疾患は多岐にわたるが、ほとんどが自然に回復し問題にならないことが多い。しかし、急性腹症の約3人に1人は診断のつかないNSAPであることが報告されており5)、また、塞栓・出血・穿孔等の緊急疾患や癌が原因となることもある。さらに、AHPのような稀な疾患が潜んでいることもあるため、鑑別診断が極めて重要となる。こうした腹痛の診断が困難であることなどが背景となり、「急性腹症診療ガイドライン2015(以下、急性腹症ガイドライン)」6)が作成された。
急性腹症ガイドラインは、従来のガイドライン(疾患の治療のためのガイドライン)とは異なり、症状/病態の診断と初期治療のための指針が示されている。本ガイドラインのポイントとしては、急性腹症の診療アルゴリズムとして「2 steps-method」や、問診について「OPQRSTの症状聴取」などが採用されており、日本内科学会認定内科救急・ICLS講習会(JMECC)と共通した内容で初学者も利用しやすい内容になっていることである。また、エビデンスと臨床的有用性を意識した診察の解説がなされており、Carnett徴候(腹壁圧痛試験)など診断に有用な手技が積極的に紹介されている。さらに、画像診断(特にCTの有用性と限界/被曝リスク)について詳細に検討されている。なお、本ガイドラインは、改訂が予定されている。
NSAPを起こす疾患としてAHPがある。腹部症状を中心とした急性発作の発症からAHP診断までの期間は平均15年との報告もあり7)、多くの未診断症例が存在している可能性がある。鑑別診断を厳格に行い、こうした患者を救うことが総合診療医にとって最も重要な課題の1つであり、AHPは重要視すべき疾患といえる。
日本の調査結果を参考に独自に計算した結果、AHPに占める各病型の割合は、AIP67.3%、HCP13. 8%、VP18.9%であった(図❷)。日本でのポルフィリン症の有病率の低さを考慮すると、HCPやVPとの遭遇頻度はかなり低い。急性腹症ガイドラインでは、腹部疝痛を繰り返す時の鑑別疾患としてAIPが挙げられている。AIPでは、発作期だけでなく、間欠期でも尿中のALA及びPBGが高値を示す。そのため、ポルフィリン症が疑われる場合は尿検査を行い、AIPを見逃さないことが重要である。
AHPの遺伝子解析
-
諏佐 真治
先生
山形大学医学部 内科学第三講座(第三内科)准教授
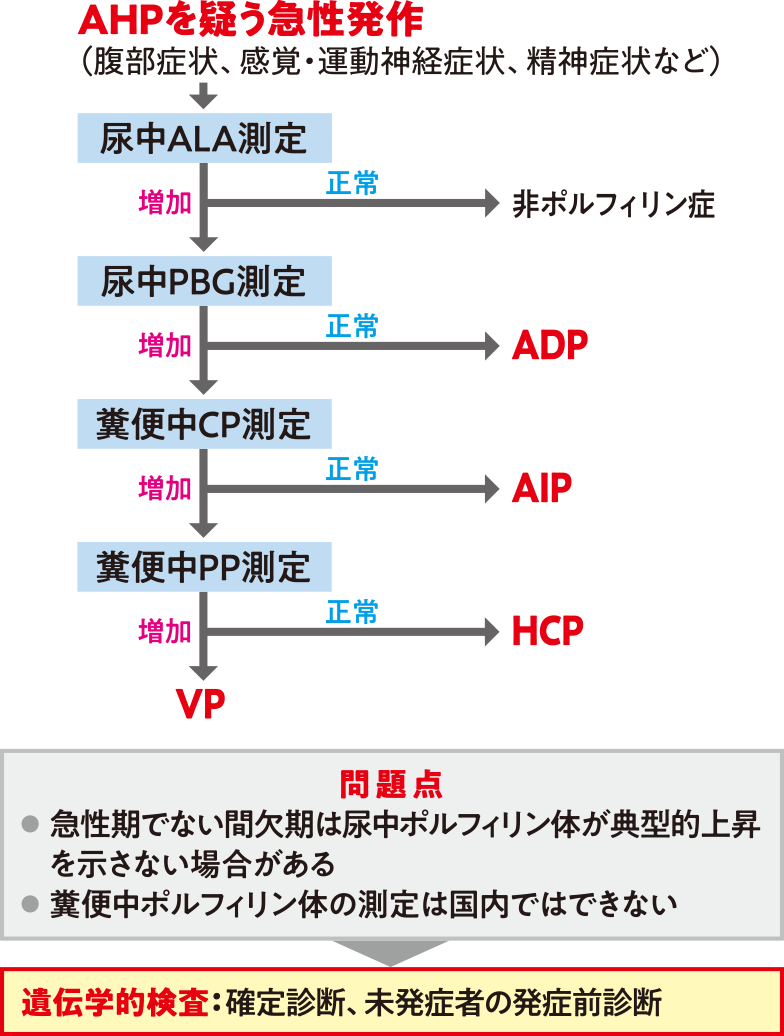
図❸AHPの診断
- AHP
- 急性肝性ポルフィリン症
- ADP
- アミノレブリン酸脱水酵素欠損ポルフィリン症
- AIP
- 急性間欠性ポルフィリン症
- HCP
- 遺伝性コプロポルフィリン症
- VP
- 異型ポルフィリン症
- ALA
- アミノレブリン酸
- PBG
- ポルフォビリノーゲン
- CP
- コプロポルフィリン
- PP
- プロトポルフィリン
(諏佐真治 先生 ご提供)
AHPを疑う急性発作(腹部症状、感覚・運動神経症状、精神症状など)がみられる場合は、図❸に示したフローで、診断を進める。ただし、間欠期は尿中ポルフィリン体が上昇しない場合があることや、糞便中ポルフィリン体は国内で測定できないなどの問題点があることから、これを補う目的で確定診断や発症前診断のために遺伝学的検査が行われている。
ポルフィリン症はヘム生合成経路に関わる酵素異常で発症する疾患であり、AHPの関連酵素には、アミノレブリン酸脱水酵素欠損ポルフィリン症(ADP)のALA脱水酵素(ALAD)、AIPのPBGD/HMBS、HCPのCP酸化酵素(CPOX)、VPのPP酸化酵素(PPOX)の4つがある。ただし、ADPは極めて稀であり世界でも数例しか報告されていないことから、AHPの遺伝子解析については、HMBS遺伝子、CPOX遺伝子、PPOX遺伝子の3つが対象になる。
現在、遺伝子解析は次世代シークエンサーによるエクソーム解析で行うのが一般的である。しかし課題として、①プロモータやイントロン領域をカバーしていない、②欠損や挿入変異を十分に検出できない、③情報量が多く、コストが高い、などが挙げられる。そこで、プロモータ領域も含む独自のカスタムプライマーを用いた次世代シークエンスが有用となる。カスタムプライマーによるAHP関連遺伝子のカバー領域はAIPで90.5%、HCPで93.5%、VPで88.4%であり、本法を用いれば、短期間かつ低コストで既存のエクソーム解析では検出できなかった遺伝子変異をほぼ検出できるようになる。
なお、AHP診断のための遺伝学的検査は保険収載されており(AIP、HCP、VP:5,000点)、公益財団法人かずさDNA研究所かずさ遺伝子検査室オーファンネット・ジャパンかずさに依頼可能である。
今後、より多彩な遺伝子変異を同定できるシステムを検討し、AHPなどの稀な疾患の診断や治療方針の検討のために役立てていきたい。
- 1)
- Stone R. Lippincotts Prim Care Pract. 1998;2(4):341-357.
- 2)
- Balwani M, Wang B, Anderson KE, et al. Hepatology. 2017;66(4):1314-1322.
- 3)
- Baravelli CM, Sandberg S, Aarsand AK, et al. J Intern Med. 2017;282(3):229-240.
- 4)
- Pallet N, Mami I, Schmitt C, et al. Kidney Int. 2015;88(2):386-395.
- 5)
- Miettinen P, Pasanen P, Lahtinen J, et al. Ann Chir Gynaecol. 1996;85(1):5-9.
- 6)
- 急性腹症診療ガイドライン出版委員会 編. 急性腹症診療ガイドライン2015, 第1版, 医学書院, 2015.
- 7)
- Bonkovsky HL, Maddukuri VC, Yazici C, et al. Am J Med. 2014;127(12):1233-1241.
